НОВИ ТЕРАПИИ И ТАКИВА В ПРОЦЕС НА ИЗПИТВАНЕ

„В бъдеще човек няма просто да бъде диагностициран с определен тип лимфом – лекарите ще могат да определят какво се е случило с клетките на генетично ниво.”
Др. Андрю Дейвис.
Размерите на проблема
Дифузният В-едроклетъчен лимфом /агресивен неходжкинов лимфом/ е най-често срещаният тип лимфом, следван от Фоликуларният /индолентен неходжкинов лимфом/. Повече от 50% от пациентите с лимфом са диагностицирани с един от тези два вида, но всъщност са описани повече от 50 различни видове лимфоми. Всички те се проявяват по различен начин при отделните пациенти и често се налага да бъдат лекувани по различен начин.
Затова, когато преценяваме терапията за даден лимфом, новото лекарство, прилагано за определен тип лимфом може да се окаже неподходящо за друг тип. Също така медикаментите, прилагани за лечение на най-разпространените видове лимфом, може да не дават ефект при редките видове /които всъщност са половината от всички лимфоми/.
Използваната към момента химиотерапия, особено в комбинация с Rituximab, повлиява много добре някои видове лимфом. Това, което трябва да проучим, е защо при някои хора резултатите са много добри, а при други – не толкова. Традиционно правим това, като изследваме ефективността на химиотерапията чрез добавяне на нови медикаменти, прилагане на по-интензивен режим на приемане на медикаментите, намиране на нови начини за прилагането им или на нови лекарства, които да облекчават страничните ефекти.
Все повече обаче напоследък се проучват медикаменти, които работят по нов начин – прицелват се в специфичните лимфомни клетки.
Последни проучвания за лечението на Дифузен В-едроклетъчен лимфом
Въпросът тук е: „Да продължим ли да прилагаме конвенционалната R-CHOP терапия на всеки 3 седмици, или тя ще е по-ефективна ако се прилага на всеки 2 седмици?” Оказва се, че прилагането на 2 вместо на 3 седмици не дава по-добри резултати по отношение на продължителността на ремисията.
В Германия, Франция и САЩ са правени проучвания как могат да се подобрят перспективите за пациенти, които не дават добър отговор на R-CHOP терапията. В Германия това лечение бе съпоставено с прилагането на интензивна химиотерапия. Последната обаче не показа по-добри резултати, а пациентите, на които бе приложена, демонстрираха повече странични ефекти, вследствие на повишената токсичност.
Затова трябва мъдър подход
Моето виждане е, че едва ли ще постигнем големи успехи в лечението на лимфомите чрез добавяне на повече химиотерапия от прилаганата в момента. Химиотерапията убива лимфомните клетки, но също така уврежда здрави клетки. Затова тези медикаменти предизвикват толкова много странични реакции. Трябва наистина мъдро да подходим към разработването на новите медикаменти.
Нужно е да разберем защо се появява лимфомът, защо нараства. Ако успеем да установим къде е възникнала грешката, ще можем да насочим лечението към конкретния проблем.
В това отношение напреднахме много. Преди десет години направихме карта на човешкия геном и това ни даде възможност да използваме информацията, за да разберем какво се е случило в ДНК-то на лимфомната клетка.
В едно проучване с 300 пациенти с дифузен В-едроклетъчен лимфом, специалистите се съсредоточиха върху въпроса кои гени се „включват” и кои „се изключват” при този тип лимфом и дали картината е различна при различните пациенти. Това, което откриха е, че въпреки че всички лимфоми изглеждат по подобен начин под микроскоп, има два типа дифузен В-едроклетъчен лимфом. Единият се нарича АВС-тип /от “activated B cells” – генетичният модел напомня активирани лимфоцити/, а другият – GCB-тип /моделът е на лимфоцити в част от нормален лимфен възел – germinal centre B cells/.
Пациентите с GCB профил се повлияха по-добре от лечението с R-CHOP от тези с АВС тип лимфом. След като знаем това, можем да си обясним защо различните хора дават различен отговор на R-CHOP терапията и съответно да я прецизираме за всеки тип.
Нови терапии в процес на изпитване
Има много видове медикаменти в процес на изпитване. След успеха на Rituximab бяха разработени нови антитела. Вече има медикаменти, повлияващи и блокиращи специфични процеси, водещи до възникването на раковите клетки /рathway inhibitors/ като темсиролим например. Това са медикаменти, които блокират сигналните процеси в раковите клетки, отговорни за деленето и нарастването им.
Започваме да разбираме биологията на лимфома. Вярвам, че в бъдеще няма просто да бъде диагностициран типа лимфом, а лекарите ще могат да разберат какъв погрешен процес е протекъл в клетките на генетично ниво. Това ще ни даде възможност още по-акуратно да насочим лечението в правилната посока. Ще знаем кой пациент би се повлиял добре от химиотерапията и кой не би отговорил задоволително на нея, но би се повлиял от други видове лекарства. Някои хора може да имат нужда само от терапия с антитела, а други – да се нуждаят от лечение със специфични медикаменти, които блокират сигналните процеси в раковите клетки, отговорни за деленето и нарастването им. Ако разберем какво не е наред генетично, ще можем да се прицелим правилно.
Бъдещето на Rituximab
С новите медикаменти ние се прицелваме в белтъците на повърхността на раковата клетка, прицелваме се в клетките, привлечени от лимфома и в някои от погрешните клетъчни пътеки в лимфомната клетка.
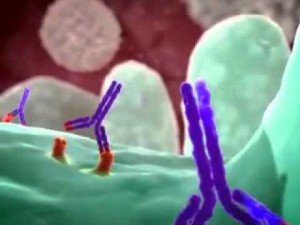
Белтъците на повърхността на лимфомните клетки са потенциалните цели на новите терапии, особено ако белтъкът се намира само върху лимфомните клетки, а не и върху здравите лимфоцити.
През последните 12-15 години, Rituximab се превърна в крайъгълен камък при лечението на повечето В-клетъчни лимфоми.
Rituximab не е химиотерапия, а антитяло – голяма молекула във формата на Y, която се прикачва за белтъка, наречен CD20, намиращ се на повърхността на В-клетките /лимфомните клетки/. Когато Rituximab се прикачи към В-клетката, други имунни клетки биват привлечени към „маркираната” В-клетка и помагат да бъде убита.
Знаем, че добавянето на Rituximab към конвенционалната химиотерапия значително подобрява успеха на лечението – не само се повишава броят на повлиялите се от терапията пациенти, а и шансовете им да останат без болестта продължителен период от време.
Прилагането на Rituximab обаче е предизвикателство. Първият прием трае около 5 часа, тъй като първоначалното вливане трябва да се направи много бавно, за да не предизвика реакция на организма срещу лекарството. Последващите вливания могат да бъдат направени значително по-бързо, защото ако изобщо има реакция, тя се проявява първия път. Ако не се прояви тогава, няма да се случи и по-късно.
Обнадеждаваща промяна в прилагането на Rituximab е разработването на подкожна форма на лекарството. Това означава прием на лекарството като подкожна инжекция. За да се постигне това, концентрацията на медикамента бе повишена до краен предел. Повишаване на концентрацията до фактор 12 означава, че цялата доза може да бъде побрана в 11.7 мл течност. Към инжекцията е добавен ензимът хиалуронидаза. По този начин бързо се разрушава част от съединителната тъкан под кожата и това позволява инжектиране на по-големи обеми. Инжекцията се поставя за около 6 минути, докато инфузията на Rituximab във вената отнема 3-5 часа.
По отношение на концентрацията на лекарството в тялото на пациента и неговата ефикасност, подкожно прилаганият медикамент е ефективен колкото и интравенозно приложеният. Не се наблюдават някакви специфични странични реакции, макар че някои пациенти усещат леко дразнене и получават зачервяване на мястото на инжекцията за кратко.
Подадено е заявление до Европейските лицензиращи власти и се надяваме да бъде получено одобрение за подкожно предлагане на Rituximab в началото на 2014 година.
При някои хора обаче, Rituximab не е ефективен и заболяването не отшумява или се връща отново. В момента се разработват няколко други антитела, които се надяваме да проработят при тези пациенти.
Антитела в процес на разработка
GA101 е антитяло, което е в трета фаза на проучване за лечение на фоликуларни и дифузни В-едроклетъчни лимфоми. GA101 се свързва с клетката под ъгъл, различен от Rituximab, и именно този ъгъл предизвиква различният ефект. GA101 изглежда по-добър от Rituximab в мобилизирането на клетките на имунната система и предизвикване смъртта на лимфомната клетка. Надяваме се клиничните проучвания да покажат дали GA101 в действителност е по-добър или не от Rituximab.
Другo антитяло в процес на разработка e ofatumumab, който се използва за лечение на Хронична лимфоцитна левкемия /CLL/ и в момента се проучва за лечение на дифузен В-едроклетъчен лимфом.
Inotuzumab е ново антитяло, което показва добри резултати при пациенти с рецидив на фоликуларен лимфом и при пациенти с дифузен В-едроклетъчен лимфом, включително при рецидив.
Brentuximab vedotin е прицелна терапия за пациенти с Ходжкин, при които се е получил рецидив след трансплантация на стволови клетки, или за такива, които не са подходящи за трансплантация. Също така е подходящ за пациенти с необичайна форма на анапластичен Т-клетъчен лимфом. Това лекарство е комбинация от антитяло и химиотерапия и се прицелва в белтък, разположен на лимфомната клетка, наречен CD30. Когато Вrentuximab vedotin влезе в лимфомната клетка, той освобождава своята доза химиотерапия, която убива клетката. При пациенти с Ходжкин с рецидив след трансплантация, при които обикновено лечението с друг курс химиотерапия е затруднено, наблюдаваме почти 80% отговор. Почти всички пациенти, получили тази терапия имат намаление на размерите на лимфните възли.
Други нови терапии
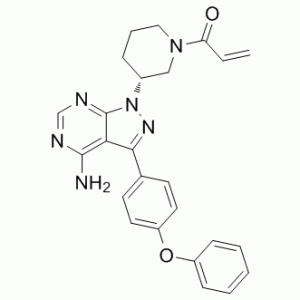
Ibrutinib е лекарство, което може да се приема през устата и изглежда обещаващо за лечението на Хронична лимфоцитна левкемия и мантелно-клетъчен лимфом. Таблетката, която се взема веднъж дневно, дава малко странични ефекти и показва отговор между 60 и 70 %. Очаква се да може да бъде прилагана и при лечението на дифузен В-едроклетъчен лимфом.
Bendamustine е използван в Източна Германия в продължение на повече от 30 години за лечение на различни видове рак. Бе проведено важно проучване относно употребата на Bendamustine заедно с Rituximab /комбинация B-R/ при пациенти с фоликуларен лимфом и други индолентни форми, които не са получавали друга химиотерапия преди това. Това проучване направи сравнение между B-R комбинацията и R-CHOP химиотерапията, давана на три седмици.
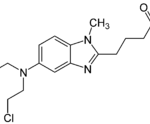
Първоначалните тестове показаха подобрение и отчетоха по-малко странични ефекти при B-R лечението: броят на белите кръвни клетки не намалява толкова, косата на пациентите не окапва, не предизвиква изтръпване на крайниците /периферна невропатия/ – все явления, които се явяват проблем при CHOP. Отрицателно явление е, че някои пациенти получиха обрив от Bendamustine.
Прицелване в клетките, заобикалящи лимфомната
Лимфомните клетки не се намират в тъканите изолирани. Около тях има други клетки – съединителна тъкан, друг тип лимфоцити и т.н. Лекарство, наречено Lenalidomide, братовчед на Thalidomide, е в състояние да атакува други клетки на имунната система, както и да предизвика смъртта на самата лимфомна клетка.
Това лекарство се оказва доста добро за пациенти със специфичен вид дифузен В-едроклетъчен лимфом. Но също така предизвиква интерес при редица проучвания в САЩ, прилагано в комбинация с Rituximab за първично лечение на фоликуларен лимфом. При прилагането на тази комбинация почти всички пациенти дадоха добър отговор.
Засега е рано да преценим колко дълго ще продължи ефекта, както и не сме наясно с токсичността в дългосрочен план, но това е нехимиотерапевтична комбинация, която дава обнадеждаващи резултати на този ранен етап от проучванията.
Заключение
Изминахме дълъг път с конвенционалната химиотерапия, но изглежда няма да направим последващи големи крачки само с нея. С всяка изминала година разбираме все повече биологията на различните типове лимфом и можем да използваме тези познания, за да насочваме по-прецизно терапиите към различните лимфомни клетки. С тази по-голяма прецизност се надяваме да направим терапиите по-ефективни и по-лесни за понасяне.
Др. Андрю Дейвис,
лектор по медицинска онкология и консултант в болницата в Саутхемптън.
